12. Equilibrio de una reacción química
En el proceso de formación de
producto de muchas reacciones químicas, se llega a un punto en el cual el
propio producto empieza a reaccionar para dar un nuevo reactivo. Es decir, la
reacción ocurre de forma reversible. Cuando la velocidad de formación de
producto y reactivo se igualan se dice que la reacción alcanza el equilibrio. La mayoría de las
reacciones que tienen lugar en la célula son reacciones reversibles, y por lo tanto tienden a alcanzar dicho equilibrio químico.
En el equilibrio las velocidades
se igualan y la relación entre la concentración de productos y reactivos es
constante.
La termodinámica es la que ayuda a predecir
si una reacción química se produce de forma espontánea o no. El cambio de
energía libre de Gibbs (∆G) de una
reacción se calcula como un incremento:
Si la reacción está en
equilibrio, su ∆G será igual a 0. Si la reacción tiene una ∆G positiva, el
reactivo tendrá menor energía que el producto y por lo tanto, la reacción no ocurrirá de
forma espontánea. En este caso se deberá utilizar energía de otra reacción para
que se pueda llevar a cabo. El valor de ∆G proporciona información de la espontaneidad
de la reacción, pero no sobre la velocidad a la que ocurre.
13. Reactividad de las moléculas biológicas
La presencia de grupos
funcionales en las biomoléculas proporciona sitios reactivos, donde se van a
poder unir a otras. Los sitios activos pueden ser nucleófilos o electrófilos,
según la capacidad de atraer o no electrones.
- Centros nucleófilos (atracción por el núcleo): Son grupos ricos en electrones y pueden tener carga negativa, pares de electrones no enlazantes o poseer una densidad electrónica típica de dobles enlaces. Estos sitios atacarán a grupos cargados positivamente, ya que se sienten atraídos por ellos.
- Centros electrófilos (atracción por electrones): Tienen atracción por las cargas negativas, es decir, ricas en electrones, debido a su carencia de estos en la capa de valencia.
Hay que tener en cuenta que un
grupo funcional puede general un dipolo, portando ambos tipos de centros.
Las reacciones de condensación o deshidratación
son un tipo de reacciones químicas que van a tener un papel fundamental. En
este tipo de reacciones participan diferentes grupos funcionales polares, que
con la formación de un enlace covalente liberan agua al medio. Son
determinantes para la formación de polímeros (polisacáridos, lípidos, proteínas
y ácidos nucleicos). Los diferentes tipos de enlaces que darán moléculas
biológicas son:
Otro tipo de reacción
característica que tiene lugar en la célula es aquella en la cual se transfieren
electrones de un sustrato a otro y son denominadas de oxidación-reducción o rédox.
La mayoría de las reacciones que ocurren durante el metabolismo son de este
tipo. Para ello se necesita un reactivo que ceda electrones y otro que los
acepte. En moléculas biológicas, esta transferencia de electrones se realiza
habitualmente en forma de átomos de hidrógeno.
El poder energético de las
sustancias orgánicas será mayor cuanto mayor sea el poder de oxidación (cuanto más reducida esté la sustancia), por lo que, durante el proceso
de oxidación, se deprenderá gran cantidad de energía.
El metabolismo celular se encarga
de transformar y almacenar este contenido energético de las moléculas reducidas, que la célula usará como fuente de energía.
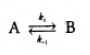



No hay comentarios:
Publicar un comentario