La mayoría de los glúcidos están en forma de grandes polímeros denominados también glucanos. Se pueden distinguir: homopolisacáridos y heteropolisacáridos si están formados
por el mismo o diferentes monosacáridos, respectivamente.
Los polímeros de glucosa con
enlaces tipo α son la
reserva energética de los organismos
Los organismos almacenan glucosa
en grandes polímeros. Las plantas en forma de almidón, los animales en forma de
glucógeno y las bacterias y levaduras en forma de dextranos.
El almidón está formado por amilosa y amilopectina. La amilosa es un polímero lineal de
glucosas unidas por enlaces (α1->4).
La amilopectina también está unida
por enlace (α1-->4), pero con ramificaciones cada 24-30 residuos, por enlace (α1-->6). El almidón es abundante en
la patata, arroz y semillas.
El glucógeno
está altamente ramificado cada 8-12 residuos de glucosa unidas por enlaces (α1-->4) mediante enlaces (α1-->6). Tiene una masa molecular muy
alta y se almacena, en forma de gránulos, principalmente en el hígado y el músculo.
Cada rama tiene un extremo no reductor. Las enzimas encargadas de eliminar
moléculas de glucosa de los extremos no reductores pueden trabajar a la vez,
haciendo que la obtención de glucosa a partir de glucógeno se haga de forma rápida.
Otra ventaja del glucógeno es su baja osmolaridad. Si tuviéramos que almacenar
las mismas glucosas en forma de monosacárido, la osmolaridad sería tan elevada
que provocaría la entrada masiva de agua.
 |
| Los puntos menos oscuros muestran los extremos no reductores, donde actuarán las enzimas |
Los dextranos son polímeros
de glucosa unidos por enlaces (α1->6) con ramificaciones (α1-->3), pero
pueden tenerlas además (α1-->2) y (α1-->4). Son sintetizados por bacterias y levaduras, y
tienen una importancia relevante en la formación de la placa dental, dado su
carácter pegajoso. Son importantes en la formación del biofilm, lo que permite que las bacterias de adhieran. También los
utilizan como fuente de nutrientes.
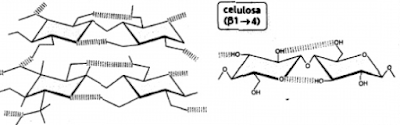
Las paredes celulares están formadas por polisacáridos con uniones tipo β
La celulosa, que forma la
pared de las células, y la quitina,
que forma el exoesqueleto de los artrópodos, son homopolisacáridos que forman
estructuras insolubles.
La celulosa
está compuesta por polímeros lineales de glucosas unidas por enlaces (β1-->4). La quitina es igual pero difiere en que la
glucosa está N-acetilada en el carbono 2. Ambos polímeros son lineales y la
disposición en el espacio de los anillos de pirano, experimentan una rotación
de 180º con respecto a las moléculas vecinas. Además, la alta presencia de
grupos hidroxilo, permite la formación de puentes de hidrógeno intracatenarios
e intercatenarios, lo que da lugar a estructuras rígidas.
Las bacterias también tienen paredes celulares rígidas formadas por
polisacáridos (β1-->4). El peptidoglucano
es un heteropolisacárido formado por N-acetilglucosamina y N-acetilmurámico
unidos alternados por (β1->4). A diferencia de las anteriores, estos se unen
por enlace covalente, y no por puentes de hidrógeno. Estos enlaces se realizan
entre las cadenas cortas de aminoácidos y los grupos –OH de los azúcares. Esto
le da gran rigidez a la pared bacteriana, y la protege de los cambios del medio
externo. Además, alternan aminoácidos D y L, lo que hace que sean difícilmente atacadas
por enzimas, ya que solo reconocen los enlaces L-aminoacídicos.
El agar es un polisacárido
de las paredes de las algas rojas marinas. Su característica principal es la
capacidad para formar genes muy hidratados que se utilizan como soporte en muchas
técnicas como la electroforesis, crecimiento de colonias bacterianas…
Los glucosaminoglucanos son los polisacáridos estructurales de los tejidos animales
Las células animales se encuentran rodeadas de un material gelatinoso,
la matriz extracelular, que mantiene
unidas a las células. Está formada por heteropolisacáridos y proteínas fibrosas
como el colágeno y la elastina; y por proteínas de anclaje a las células
epiteliales como la fibronectina y la laminina. La consistencia gelatinosa es
provocada por los glucosaminoglucanos
(GAG). Estos, proporcionan a los tejidos resistencia a la compresión y
rellenan los espacios intercelulares. Además, permiten la difusión de
nutrientes y oxígeno por los tejidos.
Básicamente están formados por N-acetilglucosamina o
N-acetilgalactosamina unidos a un ácido urónico, normalmente D-glucurónico o
L-idurónico. Algunos presentan sulfatos esterificados que aumentan las cargas negativas.
La naturaleza ácida provoca una disposición en el espacio muy extendida y también
promueven la asociación con moléculas que interaccionan electrostáticamente con
ellas (importante en el reconocimiento específico de gran número de ligandos).
El ácido hialurónico es uno
de los principales GAG de la matriz extracelular. Los enlaces que mantienen unido este polímero pueden ser degradados por la enzima hialuronidasa, que es
secretada por algunas bacterias patógenas, lo que facilita que invadan tejidos.