1. La materia está constituida por átomos
La unidad fundamental de la
materia es el átomo, una partícula de tamaño muy pequeño constituida por
protones, neutrones y electrones.
En condiciones normales, los
átomos presentan carga neta debido a que su número de protones y electrones
es el mismo. No obstante, existen átomos cargados denominados iones, con una
diferencia de carga. Al perder electrones, su carga será positiva (cationes), y si los gana, su carga será
negativa (aniones).
Los protones y los neutrones se localizan
en el núcleo del átomo, en el que se encuentra casi toda la masa. Los electrones
se encuentran alrededor de éste, en los orbitales atómicos.
Cada elemento químico está formado por un tipo de átomo, que se
diferencia de otro en el número de protones presentes en el núcleo. Por lo tanto, el número de protones o número atómico (Z) define a cada elemento. Sin embargo, un mismo elemento puede
variar en su número de neutrones, lo que determina la existencia de los isótopos, que se definen como distintas formas
atómicas de un mismo elemento, que difieren en su masa.
2. Los orbitales atómicos quedan definidos por los números cuánticos
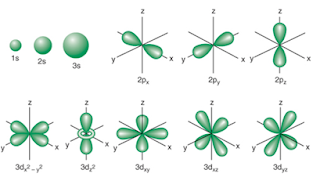
Los electrones se localizan en orbitales atómicos, que son las zonas que rodean al núcleo y donde existe la máxima probabilidad de encontrar estos electrones. Cada orbital queda definido por un conjunto de tres números denominados números cuánticos:- El primero es conocido como número cuántico principal (n): Describe el tamaño y la energía del orbital. A medida que aumenta su tamaño, lo hace su energía y su distancia al núcleo.
- El segundo se conoce como número cuántico acimutal (l): Representa un subnivel de energía y define la forma geométrica del orbital. Se representan con las letras s, p, d y f.
- El tercer número denominado número cuántico magnético (ml): Define la orientación en el espacio si se fijan unos ejes de referencia (x, y, z).
Los electrones se distribuyen en
estos orbitales siguiendo varios principios. En primer lugar, los electrones
ocupan inicialmente los niveles de energía más bajos. Cada orbital alberga un
máximo de dos electrones. Además, cuando existen varias posibilidades de
localización en subniveles de la misma energía, los electrones ocupan
subniveles separados, según el principio de la máxima multiplicidad de Hund.
Teniendo en cuenta esta
distribución, es necesario un cuarto número que permita identificar los dos
electrones del mismo orbital (numero de
spín). Dicho número refleja el movimiento de los electrones respecto a un eje imaginario
en un campo magnético.
3. ¿Qué determina el orden de los elementos en la tabla periódica?
Cada celda de la tabla periódica
contiene un elemento identificado con un símbolo, el número másico y el número
atómico. El orden de los elementos en la tabla viene determinado por dos ejes:
horizontal (períodos) y vertical (grupos). Los elementos se ordenan en un
período, de izquierda a derecha, según aumenta su número de protones. El
último elemento de cada período tiene completo su último nivel de energía y se
denomina gas noble.
4. Los elementos se combinan y forman moléculas
Un elemento es más estable cuanto
más se aproxima a una configuración electrónica en la que sus orbitales estén
completos. La unión entre átomos se establece a través de enlaces químicos, obteniéndose así las moléculas. Las moléculas que están constituidas por átomos de
diferentes elementos se denominan compuestos
(H2O).
Los electrones de las últimas
capas son los que van a participar en las reacciones químicas y se conocen como
electrones de valencia.
Para entender la formación de los
enlaces resulta útil la regla del octeto,
basada en el comportamiento químico de los gases nobles. Según esta regla postulada
por Lewis, los átomos son más estables cuando consiguen ocho electrones en la
capa de valencia.
Una propiedad importante para
explicar la formación de enlaces es la electronegatividad,
que se define como la tendencia que tienen los átomos de atraer hacia sí el par de
electrones compartido. Los átomos que tengan más electrones en su última capa
son más electronegativos.
Cuando los átomos que reaccionan
poseen una elevada electronegatividad, el enlace se forma porque ambos
elementos comparten sus electrones de valencia hasta completar su última capa (enlace covalente). En el enlace
covalente no hay una transferencia de electrones completa, como ocurre en el
enlace iónico. De la combinación de los dos orbitales atómicos surge un orbital molecular que determinará las
características de la unión. Estos pueden tener menor energía que los orbitales
atómicos, lo que lleva a una estabilización del sistema que favorece su
formación. El orbital estable se conoce como orbital enlazante. También puede tener mayor energía que los
orbitales atómicos de partida, lo que provoca una desestabilización. Este tipo
se conoce como orbitales antienlazantes.
La distribución específica de los
electrones dentro de una molécula se denomina configuración electrónica.
5. Orbitales híbridos. La tetravalencia del carbono
Para los elementos del segundo
período de la tabla periódica (C, N, O), los orbitales s y p de la última capa
están tan próximos a su nivel de energía que pueden interaccionar formando orbitales híbridos que combinan
caracteres de ambos orbitales.
6. Enlace covalente coordinado o dativo
En algunos casos el par de
electrones compartido procede exclusivamente de uno de los átomos, mientras que
el otro aporta el orbital vacío. El resultado es una molécula con carga
positiva que procede del átomo que aporta el orbital sin electrones y, por
tanto, con mayor número de protones. Para que se forme este tipo de enlace, un
átomo tiene que tener un par de electrones sin enlace, es decir un par solitario en su nivel más
externo.
7. Polaridad y enlaces polares
Cuando dos átomos de
electronegatividades muy diferentes forman un enlace covalente, los electrones
no son compartidos en igual medida por los dos átomos, de forma que serán
atraídos con más fuerza por el más electronegativo. En este caso se forma un enlace covalente polar. El átomo más
electronegativo presenta una mayor densidad de carga negativa, mientras que el
otro adquiere una densidad de carga positiva. El resultado es la formación de
un dipolo, muy importante en
interacciones no covalentes.
8. Los grupos funcionales determinan las interacciones entre biomoléculas
Los elementos químicos
fundamentales en la reactividad de las biomoléculas van a ser el O y el N,
ambos átomos electronegativos, que harán reaccionar entre sí a las moléculas
que los porten.
En las diferentes biomoléculas de
los seres vivos se encuentran, de forma recurrente, una serie de grupos funcionales. Son determinantes en
el funcionamiento de la molécula. Los más comunes en la bioquímica son:
9. Las interacciones débiles determinan la función de la molécula
Todo proceso biológico se produce
gracias a las interacciones débiles establecidas entre moléculas. La unión de
enzima con sustrato o el proceso de replicación y transcripción del ADN, son
ejemplos de procesos que tienen lugar gracias a una determinada orientación y
unión entre las moléculas implicadas. Las interacciones son débiles, pero la
suma de muchas de ellas, en la posición correcta, hará que la unión sea
altamente específica y fuerte. Algunos ejemplos son los puentes de hidrógeno, los puentes salinos (enlace iónico) y las fuerzas de Van der Waals.
9.1 Puentes de hidrógeno
Este tipo de interacción es de
naturaleza relativamente fuerte. Es responsable de las múltiples uniones
débiles entre las moléculas de agua. Para que se forme, es necesaria la
presencia de un átomo de hidrógeno unido covalentemente a un átomo
electronegativo (habitualmente O y N) que, debido a su carga parcial positiva,
será atraído por el otro átomo electronegativo presente en una molécula
diferente.
Solo son posibles con el oxígeno, nitrógeno y flúor.
Solo son posibles con el oxígeno, nitrógeno y flúor.
9.2 Enlace iónico o puente salino
En la célula, los iones (Na+,
K+, Cl-…) van a establecer entre sí, interacciones del
tipo electrostático (cargas opuestas).
Grupos funcionales que se
comporten como ácidos o bases, van a presentar una carga (un electrón de más o
de menos), lo que les convierte en un ión. Los iones en solución acuosa pueden
atraerse o repelerse según la carga que porten. Este tipo de atracción es
débil, ya que al estar el ión en solución acuosa se encuentra solvatado
(rodeado de moléculas de agua) reduciendo la fuerza de enlace entre los iones
de carga opuesta.
Debido a que la capacidad que
tiene un ácido de ceder o de captar protones depende de la concentración de H+
que haya en la solución, los grupos ácidos o básicos no siempre van a estar en
su forma ionizada. Lo grupos que se comportan como iones a pH fisiológico son, por ejemplo, los grupos amino y carboxilo.
9.3 Fuerzas de van der Waals
Son interacciones muy débiles que
mantienen unidas temporalmente moléculas no polares o átomos, es decir, son dipolos
temporales que se forman continuamente entre moléculas en solución, debido a que
el electrón se acerca o aleja del átomo al que se está enlazado.
9.4 Interacción hidrofóbica
Difieren de las anteriores en que
no presentan naturaleza electrostática. Se darán entre moléculas y grupos
funcionales no polares. No habrá entre ellos ningún tipo de
interacción: la unión se basa únicamente en la imposibilidad que tiene la
molécula hidrofóbica de interaccionar con el agua.
Son fundamentales en la biología,
ya que la naturaleza apolar de muchos componentes, les obliga a mantenerse
unidos, formando distintas estructuras, para alejarse del agua. Así formarán verdaderas barreras hidrofóbicas, como las membranas lipídicas que definen las
células y sus orgánulos.














No hay comentarios:
Publicar un comentario