Introducción general
También llamados sacáridos, son
moléculas biológicas simples que desempeñan funciones vitales. Se denominan también hidratos de carbono, ya que la mayoría de ellos responde a la fórmula
estequiométrica; (CH2O)n.
Las unidades monoméricas de estos
compuestos son los monosacáridos. La
unión de dos monosacáridos, dará lugar a un disacárido.
Cuando se unen unas pocas unidades tendremos un oligosacárido,
y cuando se unan muchas tendremos un polisacárido.
Monosacáridos
Los monosacáridos se clasifican según sus características químicas
Los monosacáridos son los
azúcares más simples. Se sintetizan a partir de precursores obtenidos de CO2
y H2O por medio de fotosíntesis. Los organismos heterótrofos obtienen los monosacáridos de los alimentos.
La principal característica de
estas moléculas es que responden a la fórmula (CH2O)n
siendo n un número entre 3 y 7.
Químicamente son polihidroxialdehidos o polihidroxicetonas.
Si el grupo carbonilo es un grupo
aldehído se denominarán aldosas, y
si es una cetona, cetosas. Según el
número de carbonos podrán ser: triosas (3 carbonos),
tetrosas (4C), pentosas (5C), hexosas (6C) y heptosas (7C). Así pues, dependiendo de cual sea su grupo carbonilo
llevarán diferente prefijo: Aldo- para aldosas y Ceto- para cetosas.
La glucosa es el monosacárido más importante y abundante. Otros monosacáridos importantes son: la galactosa y manosa. Dentro del grupo de las
cetohexosas tenemos la fructosa.
Los monosacáridos presentan isomería
Si tenemos en cuenta la fórmula (CH2O)3,
se puede observar que es válida para una aldotriosa y una cetotriosa. La
diferencia se encuentra en la posición del grupo carbonilo. Ambas moléculas son
por lo tanto isómeros estructurales, ya que tienen la misma fórmula química, pero diferente localización de sus
átomos y grupos funcionales.
Una característica fundamental de los monosacáridos
(menos en la dihidroxiacetona) es que presentan esteroisomería, debido a la presencia de carbonos asimétricos. Este término se
emplea para moléculas que son imágenes especulares no superponibles (enantiómeros). Los carbonos asimétricos son aquellos que están enlazados a cuatro sustituyentes diferentes (también llamados centros quirales).
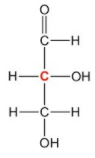
Por ejemplo, el gliceraldehído
tiene dos posibles isómeros ópticos
del tipo enantiómero.
Cada centro quiral tendrá dos
posibles configuraciones, dependiendo de la posición del grupo hidroxilo: D y L.
También hay que mencionar los
conceptos de diasteroisómero, como
todo esteroisómero que no sea enantiómero, y epímero como compuesto que difiere de otro únicamente en la
configuración de un carbono asimétrico.
Los monosacáridos en solución presentan un nuevo centro quiral
Los monosacáridos en solución
acuosa pueden adoptar una forma ciclada, cuando uno de sus grupos hidroxilo
reacciona con el grupo carbonilo del mismo. Así se forma un enlace hemiacetal (aldehído) o hemicetal
(cetona).
Los anillos que se forman: si
contienen 6 “lados” se conocen como piranosas,
por parecerse a la molécula de pirano. Si contienen 5 “lados” se denominan furanosas, por analogía al furano. Los
nuevos esteroisómeros se denominan anómeros,
y la única diferencia se localiza en la posición del grupo –OH del nuevo
carbono asimétrico (carbono anomérico).
De forma muy básica, se
denominarán con α a las moléculas
que tengan el grupo –OH del carbono anomérico hacia “abajo”, y β si está hacia “arriba”.
En solución, los anómeros pasan
libremente de la forma α a β, este fenómeno se conocen como mutarrotación.
La representación de los anillos
según la Proyección de Haworth simula un anillo plano. Sin embargo, estas
estructuras cíclicas adoptan conformaciones más estables termodinámicamente. Se
denominan conformación en silla.
Los monosacáridos modificados adquieren nuevas propiedades: Oxidaciones
La capacidad que presentan los monosacáridos de ser oxidados, hace que tengan poder reductor, siendo está una característica
distintiva de los mismos. Esta propiedad se puede utilizar para identificarlos. Por
ejemplo, pueden reducir los iones de Cu2+, haciendo que cambien de
color ante la presencia de monosacáridos.
Si la oxidación la sufre el grupo
aldehído, se produce un ácido aldónico (C-1).
Tomando como ejemplo la glucosa se obtiene ácido glucónico
(sufijo –ónico).
Si la oxidación la sufre un alcohol
primario de las aldosas (C-6) se convierte en ácido urónico (sufijo –urónico).
Si tomamos como ejemplo la glucosa obtendremos ácido glucurónico. En este caso puede presentarse en forma ciclada. En
condiciones fisiológicas estará en forma de ion negativo, denominándose
glucuronato. Se pueden oxidar los dos carbonos de los extremos, obteniéndose
así la forma aldárica (C-1 y C-6).
Las lactonas, son una forma ciclada con enlace éster. Ocurren entre el
carboxilo oxidado del carbono 1 y un alcohol de la misma molécula, generalmente el 5. Así se obtienen moléculas como el ácido ascórbico (vitamina C).
Los monosacáridos modificados adquieren nuevas propiedades: Reducciones
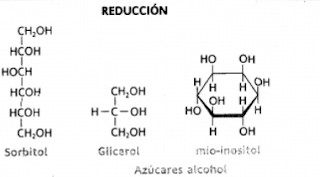
Los monosacáridos también pueden
sufrir reacciones de reducción. Se forman así moléculas como los alditoles. Dentro de este grupo tenemos
el glicerol y el mio-inositol, como parte de varios lípidos de membrana; y el
ribitol, componente de la flavina adenindinucleótido (FAD). Otros son
utilizados como edulcorantes, xilitol
y sorbitol.
Otra forma reducida son los desoxiazúcares, en los cuales se sustituye un
grupo –OH por un –H. El más importante de este grupo es la β-D-2-desoxirribosa, por ser el azúcar
presente en los nucleótidos que forman el ADN.
Los monosacáridos modificados adquieren nuevas propiedades: Esterificación
Mediante enlaces éster se pueden
unir grupos hidroxilo a un ácido fosfórico. Son importantes en la oxidación de
la D-glucosa, la D-glucosa-6-fosfato y el D-gliceraldehído-3-fosfato.
La incorporación del ácido fosfórico
se realiza por la transferencia del grupo fosforilo en una reacción catalizada
por quinasas. En esta imagen la
enzima que actúa es la hexoquinasa:
Los monosacáridos modificados adquieren nuevas propiedades: Aminoazúcares
Se dan por la sustitución del
grupo –OH del carbono 2, de un monosacárido, por una amina (-NH2).
Ejemplos son la D-glucosamina y la D-galactosamina. Además, pueden
acetilarse mediante enlaces amida, obteniéndose así, por ejemplo, la N-acetilglucosamina. Otra molécula
importante es el N-acetilmurámico,
componente de la pared bateriana. También es importante mencionar el N-acetilneuramínico, por estar presente
en muchos componentes glucoconjugados y glucolípidos. Sus derivados se nombran
como ácidos siálicos.
















No hay comentarios:
Publicar un comentario