-Microtúbulos:
Son tubos huecos y rígidos de proteínas (dímeros de
tubulina α
y β) que, en general, se encuentran en el citoplasma y son sintetizados,
a partir de anillos de tubulina, en presencia de GTP y Mg2+, por
el centro organizador de microtúbulos (MTOC), ubicado cerca del núcleo. Se
extienden desde este centro hacia la periferia de la célula. El extremo que
pertenece a la tubulina α se denomina sin crecimiento (-) y el que pertenece a la β
se denomina con crecimiento (+), debido a que es el que se extiende hacia la
periferia celular. Además, están presentes en los cilios y los flagelos.
Intervienen en varias funciones,
tales como:
- En el transporte vesicular, proporcionando un sistema de conexión similar a las vías del ferrocarril, a través del cual ocurre el desplazamiento.
- Movimiento de cilios y flajelos.
- Unión de los cromosomas con el uso mitótico y movimiento de los mismos durante la mitosis y meiosis.
- Mantenimiento de la forma celular.
- Elongación y desplazamiento celular y de orgánulos (unidos a proteínas).
-Filamentos:
- De actina: de forma similar a lo que ocurre con la tubulina, las moléculas de actina (actina G o actina libre en el citoplasma) se polimerizan en una estructura lineal helicoidal para formar filamentos, sin embargo son más finos, cortos y flexibles que los microtúbulos. El extremo de crecimiento rápido se denomina (+) y necesita la presencia de ATP, K+ y Mg2+, y el extremo de crecimiento lento se denomina (-). El control y la regulación de la polimerización depende de la concentración local de actina G y de la interacción de las proteínas de unión a la actina (ABP). Los filamentos de actina están presentes en casi todos los tipos celulares y participan en:
- Anclaje y movimiento de proteínas de la membrana.
- Mantenimiento estructural de la superficie apical de las microvellosidades de las células absortibas.
- Locomoción celular.
- Emisión de evaginaciones celulares.
- Intermedios: Se denominan así porque su diámetro es intermedio entre el de los microtúbulos y el de los filamentos de actina. Tienen función estructural. Las proteínas de estos filamentos se disponen en forma de dominio bastoniforme (en forma de varilla) central con dominios globulares a los extremos. Se forman a partir de un par de monómeros helicoidales que se enroscan entre sí formando dímeros superenrollados, y estos a su vez se enroscan entre sí, de modo antiparalelo, para generar un tetrámero escalonado. Se organizan en seis clases, dependiendo de su estructura génica, composición proteica y su distribución celular:
- Clases 1 y 2: Reciben el nombre de queratinas y representan la mayor parte de los filamentos intermedios. Las queratinas se arman en forma de heteropolímeros: molécula de queratina ácida (clase 1) + molécula de queratina básica (clase 2), formando así un heterodímero. Los filamentos de queratina se encuentran en diferentes células de origen epitelial. Mediante los desmosomas se unen con los filamentos de queratina de las células vecinas.
- Clase 3: Este grupo contiene cuatro proteínas: la vimentina, proteína de filamento intermedio de distribución más amplia (en todos los tejidos derivados del mesodermo), y otras similares a esta, tales como la desmina (en las células musculares), la ácida fibrilar glial (en las células gliales y mayoritariamente en los astrocitos) y la periferina (en neuronas periféricas). Estas proteínas, excepto la desmina, forman homopolímeros, a diferencia de las queratinas.
- Clase 4: Este grupo recibe el nombre de neurofilamentos. Se extienden desde el cuerpo neuronal hasta el final del axón y dendritas, proporcionándole sostén.
- Clase 5: Se denominan láminas, forman una estructura reticular asociada a la envoltura nuclear y están presentes en el nucleoplasma de casi todas las células diferenciadas del organismo.
- Clase 6: Se denominan filamentos perlados y se encuentran en el cristalino del ojo. Están formados por faquinina y filensina.
Las proteínas
asociadas a los filamentos intermedios son ensenciales para la integridad de
las uniones célula-célula y célula-matriz extracelular, ya que proporcionan rigidez y resistencia mecánica contra las fuerzas extracelulares.
-Centríolos:
Son cilindros citoplasmáticos cortos, en pares, con forma de vara, formados por nueve tripletes de microtúbulos. Suelen encontrarse cerca del núcleo, parcialmente rodeados por el aparato de Golgi y asociados a una zona de material pericentriolar denso. Dicha región se denomina centro organizador de microtúbulos (MTOC) y es la zona donde se forma la mayor parte de los microtúbulos y desde la que se dirigen hacia otros lugares de la célula, como ya se ha mencionado. El desarrollo del MTOC depende de la presencia de centríolos, por lo que si no hay desaparecerán y la formación de microtúbulos se verá afectada. Los centríolos proporcionan cuerpos basales necesarios para la formación de cilios y flagelos y alinean el huso mitótico durante la división celular.
Son cilindros citoplasmáticos cortos, en pares, con forma de vara, formados por nueve tripletes de microtúbulos. Suelen encontrarse cerca del núcleo, parcialmente rodeados por el aparato de Golgi y asociados a una zona de material pericentriolar denso. Dicha región se denomina centro organizador de microtúbulos (MTOC) y es la zona donde se forma la mayor parte de los microtúbulos y desde la que se dirigen hacia otros lugares de la célula, como ya se ha mencionado. El desarrollo del MTOC depende de la presencia de centríolos, por lo que si no hay desaparecerán y la formación de microtúbulos se verá afectada. Los centríolos proporcionan cuerpos basales necesarios para la formación de cilios y flagelos y alinean el huso mitótico durante la división celular.
-Ribosomas:
Son partículas compactas formadas por ribonucleoproteínas (ácidos nucléicos+proteínas). Pueden encontrarse adosados al RER, como ya se ha dicho anteriormente, o bien libres en el citosol. Están constituidos por dos subunidades que difieren en tamaño y forma: en las células procariotas su coeficiente de sedimentación es de 70S, mientras que en las eucariotas de 80S. En ellos se lleva a cabo la síntesis de las proteínas (traducción).
Son partículas compactas formadas por ribonucleoproteínas (ácidos nucléicos+proteínas). Pueden encontrarse adosados al RER, como ya se ha dicho anteriormente, o bien libres en el citosol. Están constituidos por dos subunidades que difieren en tamaño y forma: en las células procariotas su coeficiente de sedimentación es de 70S, mientras que en las eucariotas de 80S. En ellos se lleva a cabo la síntesis de las proteínas (traducción).
Existen estructuras denominadas polisomas, que se generan
cuando varios ribosomas se adosan a la vez a una molécula de ARNm para
“leerla”.
-Proteosomas:
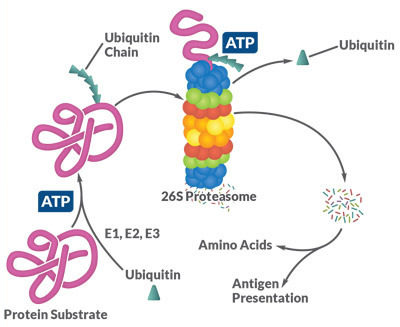
Es un complejo cilíndrico formado por cuatro anillos proteicos apilados, con un poro central. Su función es la degradación de proteínas anormales (dañadas), normales (que necesitan inactivarse) y de epítopos (lugar de unión anticuerpo-antígeno). Para que las proteínas puedan degradarse es necesario que posean marcadores denominados ubiquitinas, lo que se lleva a cabo mediante las enzimas E1,E2 y E3: activadora, conjugadora y ligasa de ubiquitina, respectivamente.
Es un complejo cilíndrico formado por cuatro anillos proteicos apilados, con un poro central. Su función es la degradación de proteínas anormales (dañadas), normales (que necesitan inactivarse) y de epítopos (lugar de unión anticuerpo-antígeno). Para que las proteínas puedan degradarse es necesario que posean marcadores denominados ubiquitinas, lo que se lleva a cabo mediante las enzimas E1,E2 y E3: activadora, conjugadora y ligasa de ubiquitina, respectivamente.


No hay comentarios:
Publicar un comentario