Se trata de un enlace por
condensación entre el grupo carboxilo de un aminoácido y el grupo amino del
siguiente. Por las características del enlace, sólo el grupo amino del primer
aminoácido (amino terminal) y el
grupo carboxilo del último (carboxilo
terminal) tienen capacidad de ionización. Es importante conocer la carga de
un polipéptido a un determinado valor de
pH porque permite predecir el tipo de interacciones que pueden darse.
1. Características estructurales
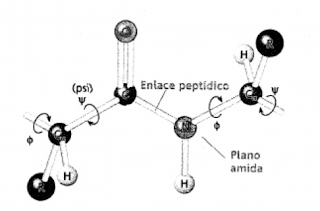
Estudios realizados por Linus Pauling
y Robert Corey demostraros que el enlace peptídico tiene una estructura plana y rígida. El enlace tiene carácter
de doble enlace que impide la rotación sobre su eje, debido a un fenómeno de
resonancia de los electrones del grupo carbonilo.
La limitación de giro del enlace
C-N hace que solo exista la configuración cis,
si el átomo de H y el grupo carbonilo están en el mismo eje, y trans, con ambos átomos en posiciones
alternas (más común). La rotación se permite en el carbono α, pero estará limitada por las cadenas
laterales que no podrán chocar.
2. El enlace peptídico permite la formación de puentes de hidrógeno
Debido a la electronegatividad de los enlaces que
componen el enlace peptídico, la molécula tiene carácter polar. Además, se
pueden formar puentes de hidrógeno entre el grupo carbonilo y un hidrógeno.
3. Péptidos de interés biológico
Por ejemplo la insulina, un
péptido formado por dos cadenas unidas por puentes disulfuro que desempeña un
papel importante en el metabolismo de los glúcidos. Se forma como una molécula
de una única cadena (proinsulina) que se convierte en su forma activa mediante
la hidrólisis de dos pequeños segmentos de dos aminoácidos.
La vasopresina y la oxitocina son
dos péptidos de nueve aminoácidos con una secuencia semejante (sólo se
diferencian en dos aminoácidos). Tienen puentes disulfuro entre Cys.

No hay comentarios:
Publicar un comentario